Primer paciente con Parkinson tratado con células ‘reprogramadas’
El caso de un paciente muestra que la terapia con células de la piel reprogramadas para generar dopamina es un procedimiento factible y seguro en Parkinson.
Podría ser un nuevo avance significativo, que llega de Japón en estas patologías: la terapia con células iPS podrían ser útiles en las enfermedades neurodegenerativas que se triplicarán en 30 años.
Hace ocho años, el premio Nobel de Medicina reconoció a Shinya Yamanaka por su técnica de reprogramación celular. El médico japonés había propuesto un cóctel de factores genéticos por el que una célula adulta podía recuperar su cualidad pluripotencial y así reparar cualquier tejido del organismo.
Esta semana la revista médica The New England Journal of Medicine (NEJM) describe el primer caso de reemplazo con neuronas dopaminérgicas obtenidas a partir de las células de la piel de un paciente con enfermedad de Parkinson. El procedimiento, efectuado en hospitales estadounidenses en 2017 y 2018, se ha mostrado factible y seguro. No es un tratamiento curativo, si bien ha logrado una mejoría clínica en un paciente de 69 años diagnosticado con Parkinson desde hacía una década. Los autores del trabajo exponen que este primer caso supone un punto de partida para el inicio de ensayos clínicos más amplios.
La técnica que se presenta ahora fue orquestada por el neurobiólogo Kwang-Soo Kim, del Hospital McLean de Boston y por los neurocirujanos del Hospital General de Massachusetts Jeffrey Schweitzer y Bob Carter. El equipo de Kim se encargó de poner las células a punto, y los cirujanos de diseñar la técnica para trasplantar las neuronas dopaminérgicas en dos intervenciones con varios meses de diferencia.
Lo médicos introdujeron las células, en un marco estéreotáxico similar al que se emplea en la estimulación cerebral profunda. Las neuronas dopaminérgicas se implantaron bilateralmente en los ganglios basales, la zona donde fisiológicamente acaba llegando la dopamina generada en el mesencéfalo.
Han transcurrido dos años desde la administración de las células y las pruebas de imagen indican que se mantienen y cumplen su función como neuronas dopaminérgicas.
Una de las ventajas de esta técnica es que trabaja con células del propio paciente; se toman de la piel, se reprograman para convertirse en células madre de pluripotencialidad inducida o iPS y luego se vuelven a diferenciar en neuronas generadoras de dopamina.
De esta forma, no hay riesgo de rechazo inmunitario ni necesidad de tratamiento inmunosupresor. “Debido a que las células proceden del paciente, están disponibles y pueden reprogramarse de tal manera que no sean rechazadas. Esto representa un hito en la ‘medicina personalizada’ para el Parkinson”, dice Kwang-Soo Kim, que dirige el Laboratorio de Neurobiología Molecular en el Hospital McLean, centro específico de Psiquiatría y Neurociencia.
Durante el tiempo que ha pasado desde la intervención, no se ha detectado toxicidad, ni signos que indiquen que las células injertadas han causado tumores, que es un efecto secundario temido en la terapia con células iPS. En cambio, sí se ha documentado una clara mejoría en los síntomas del paciente.
“Los medicamentos actuales y los tratamientos quirúrgicos para la enfermedad de Parkinson están destinados a abordar los síntomas que resultan de la pérdida de neuronas dopaminérgicas, pero nuestra estrategia intenta ir más allá, reemplazando directamente esas neuronas”, dice Kim.
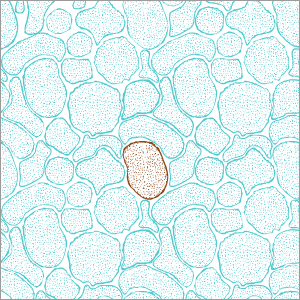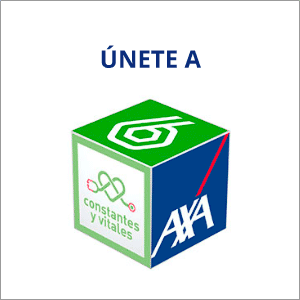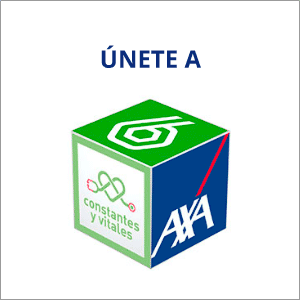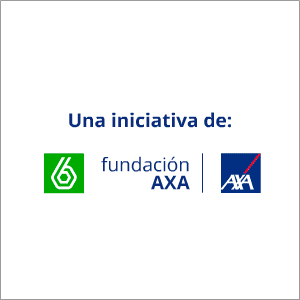
Neuronas derivadas de célula madre.
Los intentos por conseguir que células madre pluripotentes contrarresten la pérdida progresiva de neuronas dopaminérgicas en la enfermedad de Parkinson se remontan a varias décadas atrás. En los años 1980 y 1990, abanderados entre otros centros por el Instituto Karolinska (Estocolmo), se realizaron varios intentos para insertar células madre procedentes de tejido fetal y de cordón umbilical en el cerebro de pacientes con Parkinson.
Aquellos intentos de terapia con células madre no tuvieron éxito, pero “aún hoy hay pacientes que nos preguntan por esa opción”, comenta Javier Pagonabarraga, vocal del Grupo de Estudio de Trastornos del Movimiento de la Sociedad Española de Neurología (SEN).
Consultado por DM, este experto recuerda que la terapia con células madre embrionarias, al margen de las objeciones éticas que plantea, fracasó porque necesitaba inmunosupresión; no fue tan eficaz como se esperaba, puesto que las células no acabaron de implantarse bien, y, más importante aún, los pacientes desarrollaron efectos secundarios graves, en concreto, discinesia en las extremidades inferiores, que aparecían en cualquier momento del día. “Es uno de los tipos de complicaciones motoras que pueden aparecer en la evolución de la enfermedad de Parkinson”, añade el neurólogo.
Más adelante, con el cambio de siglo, Yamaka y sus células iPS reavivaron este campo de la medicina regenerativa, hasta el punto de que hay en marcha un puñado de ensayos clínicos con estas células en enfermedades oftálmicas. En 2018, también se anunció que en la Universidad de Kioto, en Japón, un paciente con Parkinson había recibido este tipo de terapia celular. No obstante, la publicación ahora de este caso en NEJM indica que el equipo estadounidense fue el pionero.
Kim llevaba años trabajando con el cóctel de Yamanaka. Perfeccionó la fórmula reprogramadora hasta hacer un sistema más seguro, basado en la utilización de un péptido, pero su sistema adolecía de ineficiencia, resultaba muy costoso obtener las células iPS. En ese punto de a investigación, conoció a George López, doblemente protagonista en esta historia. Por un lado, es el paciente que ha recibido este tratamiento experimental, pero también la persona que ha contribuido a financiar la investigación que lo ha permitido.
Un paciente altamente implicado
Al recibir el diagnóstico, Lopez, un médico internista y empresario vinculado al mundo sanitario, inició una búsqueda de posibles tratamientos que lo llevaron hasta Kim y su terapia celular en experimentación. Según cuenta un reportaje sobre la intrahistoria de este hallazgo en STAT, Lopez financió con dos millones de dólares la investigación que ha culminado en este tratamiento.
Admite que no lo hizo con la esperanza de beneficiarse personalmente de ella, pero avanzó más rápido de lo que pensaba. Finalmente, tras realizar pruebas exhaustivas con las células, Kim obtuvo la aprobación de la agencia reguladora FDA para aplicar el tratamiento dentro de un protocolo de acceso expandido para un único paciente.
La mejoría que ha alcanzado George Lopez es clara. En el tiempo transcurrido desde la cirugía, registra indicadores de una mayor calidad de vida. La terapia ha impactado en sus actividades rutinarias, como atarse los zapatos, caminar y hablar. Incluso ha vuelto a practicar algunas deportes que ya no podía hacer, desde la bicicleta a nadar. Es pronto para saber si este enfoque de tratamiento es viable, pero los autores tienen el objetivo de continuar probando el tratamiento en nuevos ensayos.
Este paciente fue también el que implicó en estudio al neurocirujano Schweitzer. “¿Quieres ser recordado como el médico que curó el Parkinson?”, le espetó por teléfono. La pregunta logró el impacto buscado, porque el cirujano se interesó por el caso y se puso en contacto con Kim. Sin embargo, no estaba planteada en términos correctos, pues este tratamiento no podía ser una terapia curativa.
El tratamiento no es curativo, sino sintomático
Pagonabarraga matiza que “no es la cura de la enfermedad, sino un tratamiento sintomático para determinados pacientes con Parkinson”. La terapia de reemplazo celular sería útil en aquellos enfermos que han desarrollado complicaciones motoras.
“Hoy en día, con los nuevos tratamientos hay un 40% de pacientes que desarrollan fluctuaciones motoras graves”. Eso supone que las medicaciones administradas no son eficaces por igual durante todo el día; ese porcentaje es el que ahora se beneficia de la estimulación cerebral profunda, así como de la infusión intraduodenal de levodopa y la administración de apomorfina subcutánea mediante bomba de perfusión. Estos abordajes, “alcanzan buenos resultados con sus limitaciones”.
La terapia celular sería una alternativa a esos tratamientos ya disponibles, apunta Pagonabarraga, para quien la administración de células, si se confirma que funciona bien, puede resultar una opción beneficiosa, aunque de momento “parece difícil de generalizar”.
El tiempo dirá si esta prueba de concepto se confirma en estudios clínicos y finalmente ofrece un nuevo enfoque terapéutico a los pacientes con Parkinson. Sonia Moreno (DM)